返信先: 腸内細菌叢が変異型p53機能をswitchingする
がん医療最新論文フォーラム › がん医療最新論文フォーラム › がん医療最新・重要論文 › 腸内細菌叢が変異型p53機能をswitchingする › 返信先: 腸内細菌叢が変異型p53機能をswitchingする
@kensho_2021pham 先生
ご質問頂きありがとうございます。質問を頂くと、私自身の勉強になりますし、他にご覧になられた方にもなにかの足しになることもあると思いますので、大変うれしく思います。
さて、まず最初の質問ですが、p53がWnt-signal pathwayを阻害することは一般的には認識されていないと思われます。
腸上皮特異的にCK1aを欠損させるとWnt活性化がみられますが、この時に変異型p53の安定性が増すことに彼らは気付きます。この論文を報告した研究室ではp53の転写因子としてのがんへの関与に着目しているようで、以前にCK1a欠損による腸がんの誘導にp53機能の欠損が必須で、それはWntのターゲット遺伝子らがp53によって抑制されるためであり、それらをPSIS(p53-suppressed invasiveness signature)として同定したことを報告しています。そのことを踏まえ、今回の論文でも実際にp53欠損腸がんマウスでPSISの発現が上昇することを確認しています。その一方で、p53R172H変異マウスでは発現上昇はみられず、トランスクリプトーム解析でも同様の結果を得ています。
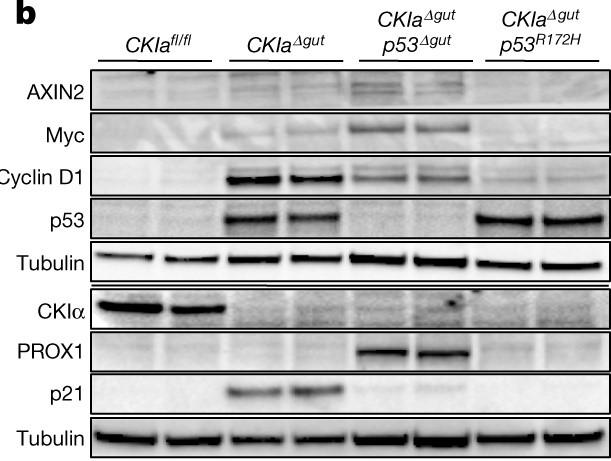
下のFig.2bのImmunoblot図では、Wntの標的遺伝子であり細胞の増殖に関与するMycやCyclin D1がWT腸がん(左から2列目)とp53欠損(左から3列目)で発現しているのに対し、p53R172H変異(左から4列目)ではほとんど発現していないことが分かります。AXIN2はWnt-signalを介在する遺伝子です。
Wnt-signal pathwayはβ-カテニンが核移行し、TCF( T cell factor)などと複合体を形成することで転写活性をもつことがしられています。このTCFの中で、腸上皮で特に多いとされるTCF4に着目し、さらに詳しいメカニズムを解明するために、彼らはChip-seqを行ってWntのターゲット領域のクロマチンにTCF4が結合しているかどうかやヒストン修飾を調べました。その結果、p53R172H変異マウスの空腸でのみTCF4の結合の低下やH3K4me3の減少が確認されました(つまりWnt-siganalのターゲット遺伝子の発現が低下)。
説明が長くなりましたが、以上の結果から、R172H変異型p53は空腸上皮におけるTCF4を介したエピジェネティック制御の阻害作用によってWnt-signal pathwayの標的遺伝子の発現を抑制するメカニズムが示唆されると思います。
2つ目のガロン酸についてですが、漢字では没食子酸(もっしょくしさん)と呼ばれていて、ポリフェノールの仲間になりますので、脂肪酸とは異なる分類になるかと思います。ガロン酸5分子がグルコース1分子とエステル結合したものがポリマーになったものがタンニンです。植物には含まれているものが多いので、日常的に少量は摂取していると思われます。食品加工学的には誘導体の没食子酸プロピルがバターなどに酸化防止剤として使われていたかと思います。また、中性脂肪や血糖値の上昇を抑える効果で機能性表示食品としての登録があります。
栄養補助食品(いわゆるサプリメント)がいくつもあるようなので、仮にガロン酸を投与するとなればそれほど難しいことではないと感じました。因みに、テアフラビンというポリフェノールからガロン酸を産生する細菌株としてLactobacillus plantarumとBacillus subtilisの2つがヒトの腸内細菌で確認されているようです。

