腸内細菌叢が変異型p53機能をswitchingする
がん医療最新論文フォーラム › がん医療最新論文フォーラム › がん医療最新・重要論文 › 腸内細菌叢が変異型p53機能をswitchingする
腸内細菌叢が変異型p53機能をswitchingする
- このトピックは空です。
-
投稿者投稿
-
-
YOSHIDA Harukaゲスト
管理栄養士ですが、がんに興味をもって過ごしております。
患者さんをはじめ多くの人とお話していると、医科学にたいして間違った認識をもっている方がとても多く、研究現場と一般社会とでかなり隔たりがあることを痛感しています。その二つの場を橋渡しするような役割を担いたいと思い、情報を正しく分かりやすく伝えるにはどうしたら良いかを模索している次第です。
大須賀覚先生の著書『世界中の医学研究を徹底的に比較してわかった最高のがん治療』も拝読させていただき、日々のアクティブな発信にいつも関心を寄せておりましたが、このような場を立ち上げてくださったということで、参加させていただきました。よろしくお願いいたします。
今回紹介させていただく論文は7月にNatureでpublishされた『The gut microbiome switches mutant p53 from tumour-suppressive to oncogenic』という基礎研究の論文です。
Nature 2020 Oct;586(7827):133-138. doi: 10.10/s41586-020-2541-0. Epub 2020 Jul 29.
腸内細菌叢が様々な疾患に関与していることが明らかになり、がんにおいても腸内細菌叢や腫瘍環境中の微生物叢に関する報告を見かけるようになりました。腫瘍微小環境の一部として認識する考えもあるようです。一方、がん抑制因子として知られるp53の遺伝子変異は多くのがん種でみられ、がん研究はp53研究と言えるほどにがん生物学のほとんどに関与しています。
今回紹介する論文著者たちは、大腸癌モデルマウスにおいて
①変異型p53が特定の機能を有すること、
②p53R172Hという変異型は、Wntシグナルを介して腫瘍進展に影響を与えていること、
③その変異型p53は腸内細菌叢によって腫瘍形成を促進したり抑制したりする機能の可塑性がみられること
を明らかにしました。
この研究では、Csnk1a1floxed/Vil1-Cre-ERT2 mouse を使うことで、セリン/スレオニンキナーゼであるCK1aを腸上皮特異的に欠損させ、β-カテニン依存性のWntシグナル伝達経路の活性化による大腸癌発生モデルを用いています。このマウスにp53変異を入れたCklaΔgut+p53 R172Hと、p53を欠損させたCklaΔgut+p53Δgutをそれぞれ用意しています。がんにおけるp53の変異は多くのパターンがありますが、今回はヒトの腫瘍において最も多く見られる変異の一つである、構成アミノ酸172番目のアルギニン(R)がヒスチジン(H)に置換されたミスセンス突然変異に着目します。
(便宜上、CklaΔgut p53 R172Hを「p53 R172H変異マウス」、CklaΔgut p53Δgutを「p53欠損マウス」と記載させて頂きます)
これらのマウスを十二指腸から結腸にかけて部位別に組織を観察すると、通常の大腸癌マウスとp53欠損マウスでは上皮の過剰な増殖・異化(つまり腫瘍の形成)がみられたのに対し、p53 R172H変異マウスでは大腸上皮での著しい異化形成がみられたものの十二指腸や空腸では上皮の増殖は正常組織と変わらず、異形成はごくわずかであることが分かりました。このことから、十二指腸などにおいてはR172H変異型p53によって、p53欠損でみられるような(通常のp53機能欠失でみられるような)発がんの促進効果を覆すことが示唆されました。
次に、p53による制御遺伝子群が、大腸癌のgate keeper gene関連分子から構成されるWntシグナル伝達経路を阻害することに着目し、モデルマウスの小腸におけるWntシグナルに関与する分子の活性化をChip-seqで調べました。その結果、p53欠損マウスではWnt-signal pathwayの活性化がみられた一方で、p53 R172H変異マウスでは活性化がみられませんでした。
P53変異モデルにおける空腸と回腸でWnt-signalの活性化に違いがみられる原因を探るために、オルガノイドを使用して空腸と回腸でそれぞれp53 R172H変異または欠損させたときの腫瘍形成を観察しました。すると、p53 R172H変異型のオルガノイドでは、空腸と回腸のどちらにおいても腫瘍形成が阻害されることが確認されました。このことから、特定のp53変異で起こる腫瘍形成の阻害効果は、組織依存的ではないことが示唆されます。そして著者たちは、腸内細菌の存在が回腸・結腸におけるp53 R172H変異の腫瘍への影響に変化を及ぼしている可能性を仮定しました。
その仮定を実証するために、マウスに抗生剤投与をして腸内細菌叢を排除すると、彼らの狙い通り、p53 R172H変異マウスの回腸・結腸における腫瘍形成がみられませんでした。この時、通常のp53マウスとR172H変異マウス間で顕著な腸内細菌叢の組成の違いはみられなかったことから、空腸と回腸・結腸とで異なる細菌叢による代謝産物が関与していると目星を付けました。
腸内細菌叢の主要な代謝産物として知られる物質を何種類かオルガノイドに振りかけると、ガロン酸処理した際にp53 R172H変異オルガノイドで増殖能とWntシグナルの活性化がみられ、ガロン酸がp53 R172H変異によるWntシグナルの阻害効果を抑制することが示唆されました。
そして実際にマウスの空腸と回腸でガロン酸が存在することを確認し、ガロン酸を産生する細菌株(合成酵素をもつ細菌株)を除去するとp53 R172H変異マウスの回腸・結腸での腫瘍形成が抑えられることがvivoでも示されました。
さらに、ガロン酸をマウスに投与すると、p53 R172H変異マウスにおける腫瘍形成を促進し、特に空腸においては強い増殖がみられ、悪性度も高いことが分かりました。この時、空腸細胞でのChip-seqで転写因子であるTCF4のクロマチン結合とWntプロモーター領域クロマチンのH3K4me3の促進によって、Wnt関連分子の発現の増加がみられたことを確認しています。
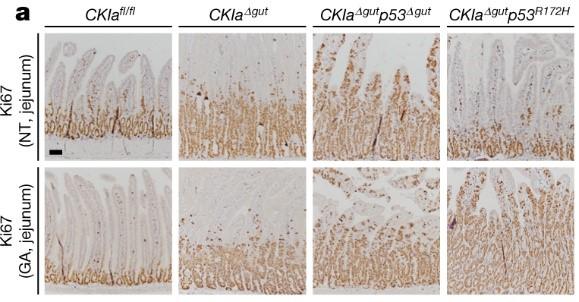
結果は以上で、マウスモデルとオルガノイドを巧みに使用して腸内細菌叢の代謝産物の有無によってp53 R172H変異の機能の可塑性を明らかにしており、著者たちは経口からの治療の可能性にも言及しています。
一方で、腸内細菌叢は共生する細菌株の構成の違いによる影響が大きく、ある特定の細菌株をターゲットとした治療や腸内細菌叢を変化させることは、臨床的にはなかなか容易でないことを感じています。また、腸内細菌叢の影響を受けにくいがん種における変異型p53の機能の変化があるのか、ある場合は何に依存しているのかを明らかにできれば、それに即した治療法が開発できるかもしれません。ゲノムmutationを調べたうえで、治療法を選択する、ということが少しずつ現実味を帯びてきたのを感じる論文でした。
Keyword: p53, Wnt-signal pathway, microbiome, organoid, 大腸がん
-
大須賀覚ゲスト
最新論文フォーラムにご参加くださって、誠にありがとうございます!新たな人に参加してもらい、本当に嬉しいです!!
ぜひ、今後とも引き続いて報告をお願いいたします。この量の報告をまとめるのも大変な作業でしょうから、もう少し要点だけでも構いませんので、ご無理をなさらない範囲で継続的にご参加いただければと思います。
さて、ご紹介いただいた論文ですが、めちゃくちゃ面白かったです。マウスモデルばかりで仕事している身としてはど真ん中の研究です。また、論理的な研究方法がエレガントですし、ガロン酸まで同定していて、その持っていき方するかと驚きました。腸内細菌叢と発がんは大きな話題となっていますが、どの細菌が多いと腫瘍増殖がどうのとか、免疫反応がどうのというような話が多くて、ここまで特定の分子との関わりを解いたのは初めて見ました。大変に勉強になりました。
貴重な報告をありがとうございました。今後ともよろしくお願いいたします。
-
okazaki yoshihisaゲスト
詳細なレポありがとうございます。
今回の論文のような現象、大変興味をひかれます。
がん生物学分野では、発癌は大御所Vogelstein先生の”多段階発癌説”が教科書的定説ですが、
個人的にはもっと奥が深い生命現象ではないかと感じています。
発癌と遺伝子の関係の面白い例:ギルバート著『発生生物学』第4章などに載っています。
遺伝子の意味=周辺環境との相互作用(腸内細菌叢など)との文脈で最終的に決まる!!
今回のように、同じ遺伝子変異でも、文脈によっては全く逆の意味を現すこともある。
今後ともよろしくお願いいたします。
-
YOSHIDA Harukaゲスト
コメントして頂きありがとうございます。
大須賀覚 先生
ありがとうございます。是非今後も参加させて頂きたいと思います。
論文についても、先生の仰る通り、言われてみれば、ですね。最近は動物モデルを用いた基礎研究でも臨床との関係性を仄めかすFigureをひとつ入れないとトップジョーナルに掲載されない傾向があると感じていましたが、そうした発見の新規性が評価されたのかもしれません。
okazaki yoshihisa 先生
貴重なご意見ありがとうございます。『ギルバート発生生物学』は色々な理由から中々手が出ませんでしたが、是非読んでみたいと思います。
蛇足ですが、用土社からギルバート氏の講義形式での書籍が来月に出版されるようです。
-
@kensho_2021phamゲスト
YOSHIDA Haruka様
大変興味深い論文紹介有難うございます。
私は、ガンも腸内細菌もあまり詳しくありませんので、妙な質問をしてしまうかもしれませんがご了承ください。
頭の整理をしながら質問させていただきます。
Wntシグナル駆動マウスかつp53欠損となると、大腸ガンが大変なことになる。
一方で欠損ではなくp53R172H変異では、腸の中でも場所によって、ガンがむしろ抑制されたりする。
疑問①:これは変異型p53にはWntシグナルの阻害作用があるということでしたが、下流にはどういう分子メカニズムがあるのでしょうか?Wntシグナルの抑制が一般的に言われていることなのであれば、頭に入れておきたいと思いましたので。
次に、この場所による違いは腸内細菌の構成、特にガロン酸を分泌できる細菌叢がいるところでは顕著にガンができてしまう。ガロン酸がp53R172HのWntシグナル阻害を邪魔するから。
疑問②とても興味深いです。ガロン酸、初めて聞きました。脂肪酸の一種でしょうか。腸内細菌の代謝産物ということは、食物繊維などの中にもガロン酸を産生しやすいものなどがありそうですが、どうなんでしょうか?
よしだ様のおっしゃられるように、ミューテーションの種類を事前に診断することが、メカニズムベースの治療には必須だと感じました。この論文はまたじっくり読みたいと思います。
ご紹介ありがとうございました。
-
okazaki yoshihisaゲスト
ギルバート先生の新書のご紹介ありがとうございます。
購入してみます。
ギルバート先生、反還元主義者として知られ、視点が新鮮です。
-
YOSHIDA Harukaゲスト
@kensho_2021pham 先生
ご質問頂きありがとうございます。質問を頂くと、私自身の勉強になりますし、他にご覧になられた方にもなにかの足しになることもあると思いますので、大変うれしく思います。
さて、まず最初の質問ですが、p53がWnt-signal pathwayを阻害することは一般的には認識されていないと思われます。
腸上皮特異的にCK1aを欠損させるとWnt活性化がみられますが、この時に変異型p53の安定性が増すことに彼らは気付きます。この論文を報告した研究室ではp53の転写因子としてのがんへの関与に着目しているようで、以前にCK1a欠損による腸がんの誘導にp53機能の欠損が必須で、それはWntのターゲット遺伝子らがp53によって抑制されるためであり、それらをPSIS(p53-suppressed invasiveness signature)として同定したことを報告しています。そのことを踏まえ、今回の論文でも実際にp53欠損腸がんマウスでPSISの発現が上昇することを確認しています。その一方で、p53R172H変異マウスでは発現上昇はみられず、トランスクリプトーム解析でも同様の結果を得ています。
下のFig.2bのImmunoblot図では、Wntの標的遺伝子であり細胞の増殖に関与するMycやCyclin D1がWT腸がん(左から2列目)とp53欠損(左から3列目)で発現しているのに対し、p53R172H変異(左から4列目)ではほとんど発現していないことが分かります。AXIN2はWnt-signalを介在する遺伝子です。
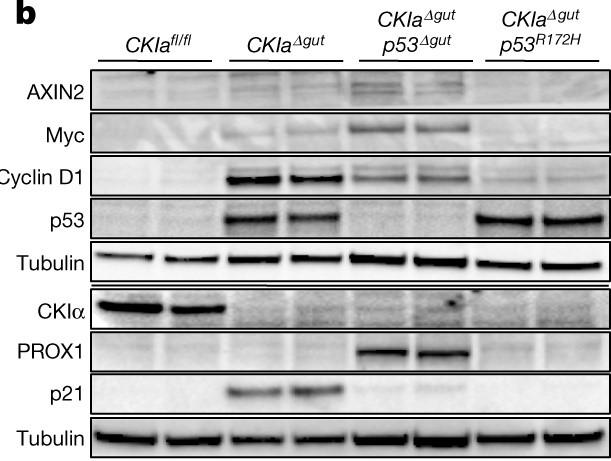
Wnt-signal pathwayはβ-カテニンが核移行し、TCF( T cell factor)などと複合体を形成することで転写活性をもつことがしられています。このTCFの中で、腸上皮で特に多いとされるTCF4に着目し、さらに詳しいメカニズムを解明するために、彼らはChip-seqを行ってWntのターゲット領域のクロマチンにTCF4が結合しているかどうかやヒストン修飾を調べました。その結果、p53R172H変異マウスの空腸でのみTCF4の結合の低下やH3K4me3の減少が確認されました(つまりWnt-siganalのターゲット遺伝子の発現が低下)。
説明が長くなりましたが、以上の結果から、R172H変異型p53は空腸上皮におけるTCF4を介したエピジェネティック制御の阻害作用によってWnt-signal pathwayの標的遺伝子の発現を抑制するメカニズムが示唆されると思います。
2つ目のガロン酸についてですが、漢字では没食子酸(もっしょくしさん)と呼ばれていて、ポリフェノールの仲間になりますので、脂肪酸とは異なる分類になるかと思います。ガロン酸5分子がグルコース1分子とエステル結合したものがポリマーになったものがタンニンです。植物には含まれているものが多いので、日常的に少量は摂取していると思われます。食品加工学的には誘導体の没食子酸プロピルがバターなどに酸化防止剤として使われていたかと思います。また、中性脂肪や血糖値の上昇を抑える効果で機能性表示食品としての登録があります。
栄養補助食品(いわゆるサプリメント)がいくつもあるようなので、仮にガロン酸を投与するとなればそれほど難しいことではないと感じました。因みに、テアフラビンというポリフェノールからガロン酸を産生する細菌株としてLactobacillus plantarumとBacillus subtilisの2つがヒトの腸内細菌で確認されているようです。
-
@kensho_2021phamゲスト
YOSHIDA Haruka様
ご返信が遅くなり申し訳ありません。研究背景から大変丁寧にご説明していただき有難うございます。
Wnt活性化⇒p53R172Hの安定性の増すのですね。
CK1a欠損⇒Wnt活性化⇒通常p53はWntシグナルの標的遺伝子を抑制する(PSIS)⇒Wntターゲット遺伝子(myc)が駆動されない
CK1a欠損⇒Wnt活性化⇒p53欠損によりWntシグナルの標的遺伝子が駆動⇒Wntターゲット遺伝子(myc)が駆動する
CK1a欠損⇒Wnt活性化⇒p53R172Hは安定性が増すので、PSISが高まりWntターゲット遺伝子(myc, cyclin D1)が全く駆動されない
p53R172HにPSISがあるは、Wntシグナルのβ-カテニン-TCF4の結合能が低下しているため。
mycとcyclin D1の挙動に少し違いがあるようですね。
大変理解が深まりました。上記の流れ間違ってないでしょうか。頭が途中で混乱しました。
ガロン酸はポリフェノールの仲間なのですね。有難うございます。
食べたものは、消化管で分解や吸収を受けるので空調や回腸の段階で口から摂取したものがどのくらい残るのだろう。
という単純な疑問があります。
一方で、食物繊維はヒトは分解できないので腸内細菌のエサになると考えられており、その代謝物としてガロン酸のような
ものが放出されているのかなという疑問です。真相は全く分かりません。
今後ともよろしくお願いいたします。
-
YOSHIDA Harukaゲスト
@kensho_2021pham 様
ご返事頂きありがとうございます。
変異型p53のロジックはその通りだと思います。ただ、p53R170HノックインマウスにおけるCk1a欠損時のp53安定性の向上は、Wnt-siganalとの因果関係についてまでは言及していなかったと思います。そのため、私自身は腸がんマウスにおける変異をいれたp53の安定性は、Wntとの関係性を保留にしたまま読み進めておりました。既に報告がある部分もあるかと存じますので、もし何かご存知の方がいらっしゃればご教授いただければ幸いです。
ポリフェノール類の吸収や代謝効率については不明な部分が多いようですが、カテキンにおいてはガロン酸を含むものの方が含まないものに比べて吸収されにくいとされる報告もあるようです。腸内細菌による代謝を経る場合だけでなく、腸の粘膜から直接吸収されるものもありますが、個体がもつ腸内細菌叢の影響も大きいと思いますので中々評価が難しいのが現状だと思います。
-
@kensho_2021phamゲスト
沢山の質問に答えていただき有難うございます。
お陰様で理解が深まりました。
(返信は不要です)
Twitter上で毎日論文紹介していますので
宜しければコメントなどお願い致します。
-
topical finasteride keepsゲスト
The compounds all demonstrated low cytotoxicity profiles suggesting that their action is cytostatic rather than cytotoxic, Table I discount finasteride Thus, p53 overexpression in endometrial carcinomas occurring in patients with breast cancer seems to be not specific for TAM treated patients, and, if DNA adduct formation has any role in this type of endometrial carcinogenesis, it may not be related preferentially to p53 gene alteration
-
-
投稿者投稿

